液晶−フラーレン超構造の創製と物性
研究代表者 舟橋正浩 東京工業大学 像情報工学研究施設 助手
研究分担者 半那純一 同 教授
1.本研究を提案するに至った経緯
フラーレンも含めて、有機固体材料において、薄膜形成能、大面積適用性が、基礎物性の解明の上でも、応用研究の上でも重要な要因となる。当研究グループでは、薄膜化、大面積化が容易な新しい有機半導体材料として、液晶性半導体を提案し、その分子設計、基礎物性、応用研究を行ってきた。フラーレンの新しい凝縮相を探索する場合も、この要因が重要であると考え、下記に示す液晶性半導体の概念をフラーレン凝集相に拡張する事を検討する。
1−1 液晶性半導体
有機半導体の材料形態に注目すると、結晶系とアモルファス系に大別できる。結晶系半導体は、多くが、芳香族化合物の単結晶であり、ホールと電子のドリフト移動度はほぼ等しく、10-1 ~ 100 cm2/Vsであり、電界強度や温度に依存しない1)。それに対して、アモルファス系半導体は、トリフェニルアミン誘導体や、それをポリマーマトリックスに分散したものである。これらの材料での電気伝導機構は、分子間のホッピング伝導で記述でき、各分子の軌道準位、および、位置の乱れを反映して、キャリア移動度は10-7 ~ 10-5 cm2/Vsと低く、電界強度や温度に顕著に依存する2)。アモルファス系有機半導体は、電気特性は結晶系有機半導体に大幅に劣るものの、低コスト、薄膜形成能、大面積適用性などの実用面で大きな長所を持つため、実用材料として広範に用いられている。
そこで、アモルファス系半導体の実用性を損なわず、物性を向上させるため、材料に分子配向性を導入する事を考え、液晶材料に注目した。液晶材料は結晶的な分子配向性を持つ事から、分子配向の乱れに起因するエネルギー的、構造的な乱れが低減され、結晶と同様の高速電荷輸送が期待できる。また、液体的な流動性を持つ事から、容易に、大面積化、薄膜化が図れるものと予測される。
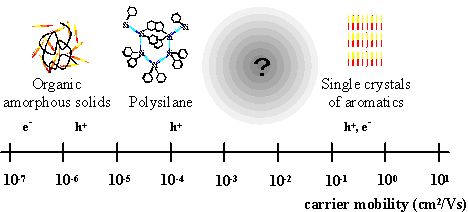
Fig. 1
Typical organic semiconductors and their carrier mobility
検討の結果、2-phenylbenzothiazole誘導体、2-phenylnaphthalene誘導体のスメクティック相において、半導体的な電荷輸送に基づく大きな光伝導性とキャリア移動度が観測された3, 4)。特に、後者では、ホールと電子が輸送され、その移動度は両キャリア共に、10-4 ~ 10-2 cm2/Vsであり、分子配向秩序が、SmA相、SmB相、SmE相と高次になるに従い、移動度は段階的に増大した4, 5)。また、両電荷の移動度は電界強度、温度に依存しなかった。このような電荷輸送特性はアモルファス系有機半導体とは異なり、結晶系有機半導体に近い性質である。これは、液晶相における分子配向性が分子のエネルギー、および、位置の乱れを低減していることと、層状構造を形成しているため、分子間の軌道の重なりが大きくなり、結晶に似た環境が実現されているためと考えられる。
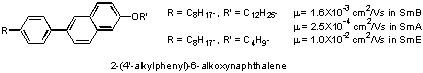
Fig. 2
Typical liquid crystalline semiconductors
これらの材料の結晶相においては、submicron程度の大きさのグレインからなる微結晶であり、粒界や構造欠陥に形成された局在準位のため、電荷輸送は円滑に進行しない。それに対して、液晶相ではその構造柔軟性のため、局在準位の密度と深さが低減されるため、微結晶相では見られない高速の電荷輸送が観測されるものと考えられる5,6)。
この様に、アモルファス材料の薄膜形成能、大面積適用性を保持しつつ、良好な電荷輸送特性を示す液晶性半導体は、高速応答の光センサー7)や偏光発光可能な電界発光素子8)に応用が可能である。
1−2 フラーレン−液晶半導体混合系の光電物性7)
Fig.2に示した液晶性半導体はいずれも、吸収領域が紫外域にある。従って、光センサーへの応用を考えた場合には、分光感度を可視域に拡大するため、色素増感が必要となる。そこで、色素として、C70をホスト液晶2-(4’-octylphenyl)-6-dodecyloxy-naphthaleneに1 wt%添加し、定常光照射下の光伝導性、パルスレーザーを用いた過渡光電流測定による応答速度の評価を行った。
Fig. 3に示すように、SmB相において、可視光照射下でも良好な光伝導性を示す。また、光電流スペクトルはフラーレンの吸収スペクトルに一致しており、フラーレン分子の励起によりキャリアが生成しているものと考えられる。過渡光電流の応答速度はmsオーダーで、フラーレンを添加しても、液晶性半導体自身が持つ高速応答は損なわれていない。以上の結果から、まず、可視光によりフラーレンが励起されてキャリアが生成し、その後、液晶分子にキャリアが移動し、液晶分子間をホッピングする事により伝導に寄与しているものと考えられる。また、分子の配向構造を持たない等方相では、キャリアがC70に捕捉されるため、光伝導性を示さず、液晶分子の蛍光もC70によって消光されるのに対して、SmB相ではC70によるキャリアの捕捉や蛍光の消光は見られない事から、SmB相では、スメクティック層間にC70分子が偏析しているものと考えられる。
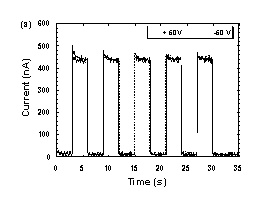
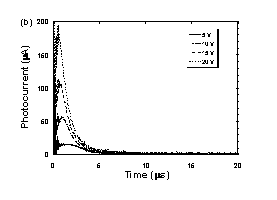
Fig. 3
(a) Photocurrent response on steady state visible light illumination (l = 470 nm, 2.5 mW/cm2) at 90℃
(SmB phase). Cell thickness was 9 mm.
(b)Transient photocurrent response on pulse laser excitation (l = 590 nm). Cell thickness was 2 mm.
本系では、フラーレン分子の密度は低く、電荷輸送は液晶分子間のホッピングにより進行しているものと考えられる。ここで、フラーレン分子の密度を向上させる事ができれば、フラーレン分子間のホッピングに基づく電気伝導を観測できると期待される。
(a) (b)
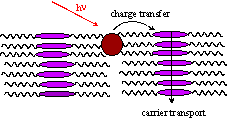
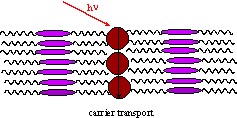
Fig. 4
photoexcitation of fullerene and carrier transport. (a) carrier transport between liquid
crystal molecules is dominant at low concentration of fullerene molecules. (b) carrier transport between fullerene
molecules can be expected at high concentration of fullerene molecules.
2.研究目的・研究計画
本研究では、液晶相での分子配向性と、超構造を利用して、フラーレン分子を並べることにより、フラーレンの新しい凝集相の創製とその物性評価を検討する。フラーレンの物性研究においては、通常、単結晶や蒸着膜が用いられている。フラーレンに液晶性半導体の概念を導入できれば、測定容易なフラーレンの凝集系を容易に構築できるものと期待できる。
A.液晶−フラーレン超構造の創製
1.フラーレン混合液晶の構造と光電物性
フラーレン分子を液晶相に混合し、フラーレン分子を配列させる。特に、スメクティック相の持つ層状構造を利用して、フラーレン分子を二次元的に並べる。通常、C60やC70は、液晶材料に対して、大きな溶解性を持たない(せいぜい、1 wt%)ので、アルキル鎖や液晶性部位などを導入して、液晶材料に対する溶解性を向上する必要がある。
2.液晶性フラーレンの合成と相構造、光電物性
フラーレン分子に液晶性部位を導入する事により、液晶性のフラーレン分子を合成する。液晶相の構造に対応した、種々のフラーレン分子の凝集状態を実現できるものと期待される。液晶の相構造は、偏光顕微鏡を用いた光学組織観察、および、X線回折法により行う予定である。
液晶相でのミクロな相分離を利用した超構造の作製は、ポリマー−液晶混合系で一部試みられているに過ぎない。また、液晶性を持つフラーレン誘導体はわずかに一例が知られているに過ぎない。この概念をフラーレンに導入した場合、通常の固体系では実現できないユニークな凝集構造を実現できる可能性がある。
(a) (b)
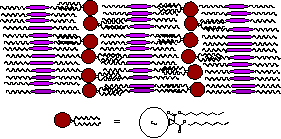
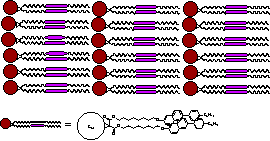
Fig. 5
Possible examples of liquid crystal-chemically modified fullerene super
structure. (a) liquid
crystal-non-mesomorphic fullerene system (b) liquid crystalline fullerene
B.液晶−フラーレン超構造の電子物性
液晶相でフラーレン分子を並べ、フラーレン分子間のキャリアのホッピングに基づく電気伝導を観測する。評価方法としては可視光照射による定常光電流測定、TOF法による移動度の評価を予定している。
フラーレンの単結晶の電気特性に関しては、電気伝導度の測定、TOF法によるキャリア移動度の測定が行われているが、通常、フラーレンの大きな単結晶の作製は溶媒が結晶に取り込まれる事もあり、容易ではない。本研究で提案するように、液晶相でフラーレン分子の配向状態を実現できれば、比較的容易に、薄膜上の試料を作成する事が出来、フラーレンの電子物性の理解のみならずフラーレンの新しい応用の可能性を示す事ができるであろうと期待される。
References
1) M. Pope and C. E. Swenberg, Electronic processes in organic crystals,
(Clarendon Press, Oxford, 1982).
2) P. M. Borsenberger and S. O. Weiss, Organic photoreceptors for imaging systems,
(Marcel Dekker, Inc., New York, 1993).
3) M. Funahashi and J. Hanna, Phys. Rev. Lett., 78, 2184-2187 (1997).
4) M. Funahashi and J. Hanna, Appl. Phys. Lett., 71, 602-604 (1997).
5) M. Funahashi and J. Hanna, Appl. Phys. Lett., 73, 3733-3735 (1998).
6) M. Funahashi and J. Hanna, Mol. Cryst. Liq. Cryst., 306, in press (1999).
7) M. Funahashi and J. Hanna, Appl. Phys. Lett., 75, 2484 (1999).
8) K. Kogo, T. Goda, M. Funahashi, and J.
Hanna, Appl. Phys. Lett., 73, 1595-1597 (1998).